選擇限制酶用于mRNA疫苗生產的6條建議
2024年5月底,美國FDA批準了Moderna公司的第二款mRNA疫苗——針對呼吸道合胞病毒(RSV)的mRESVIA(mRNA-1345)。這是全球獲批的首款非新冠mRNA疫苗。再次展現了mRNA疫苗的巨大潛力。
在mRNA疫苗的開發和生產過程中,將包含有抗原基因的環狀質粒DNA變成線狀DNA,作為此后體外轉錄反應的模板,是非常關鍵的步驟。這一步主要通過限制性內切酶的定點酶切反應完成。
在此,愚公生物為選擇mRNA疫苗開發限制酶提供如下建議:
01 選擇識別序列較長的限制酶
質粒線性化的首要要求就是酶切位點不能出現在抗原基因的內部。6堿基以上的識別序列,出現在基因內部的可能性比較小,減少了基因序列的設計難度。因此需要選擇具有較長識別序列的限制酶。
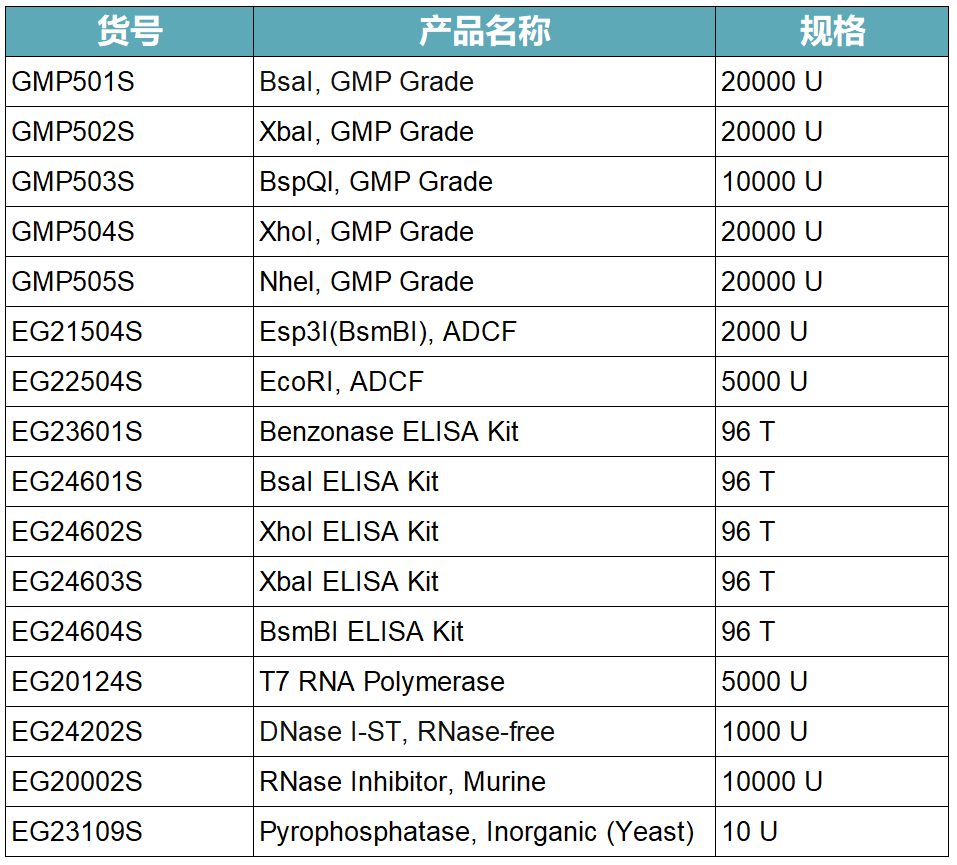
02 酶切產物末端應為5'突出
限制酶酶切產物末端應該為5'突出,因為5'突出末端出現在體外轉錄的模板鏈上。而編碼鏈末端的3'突出,會增加體外轉錄產生雙鏈RNA (dsRNA) 副產物的風險。
如下圖所示,BsaI、XbaI、XhoI酶切產物均為5'突出。而PstI、SacI酶切產物均為3'突出,不適合用于mRNA質粒模板線性化。
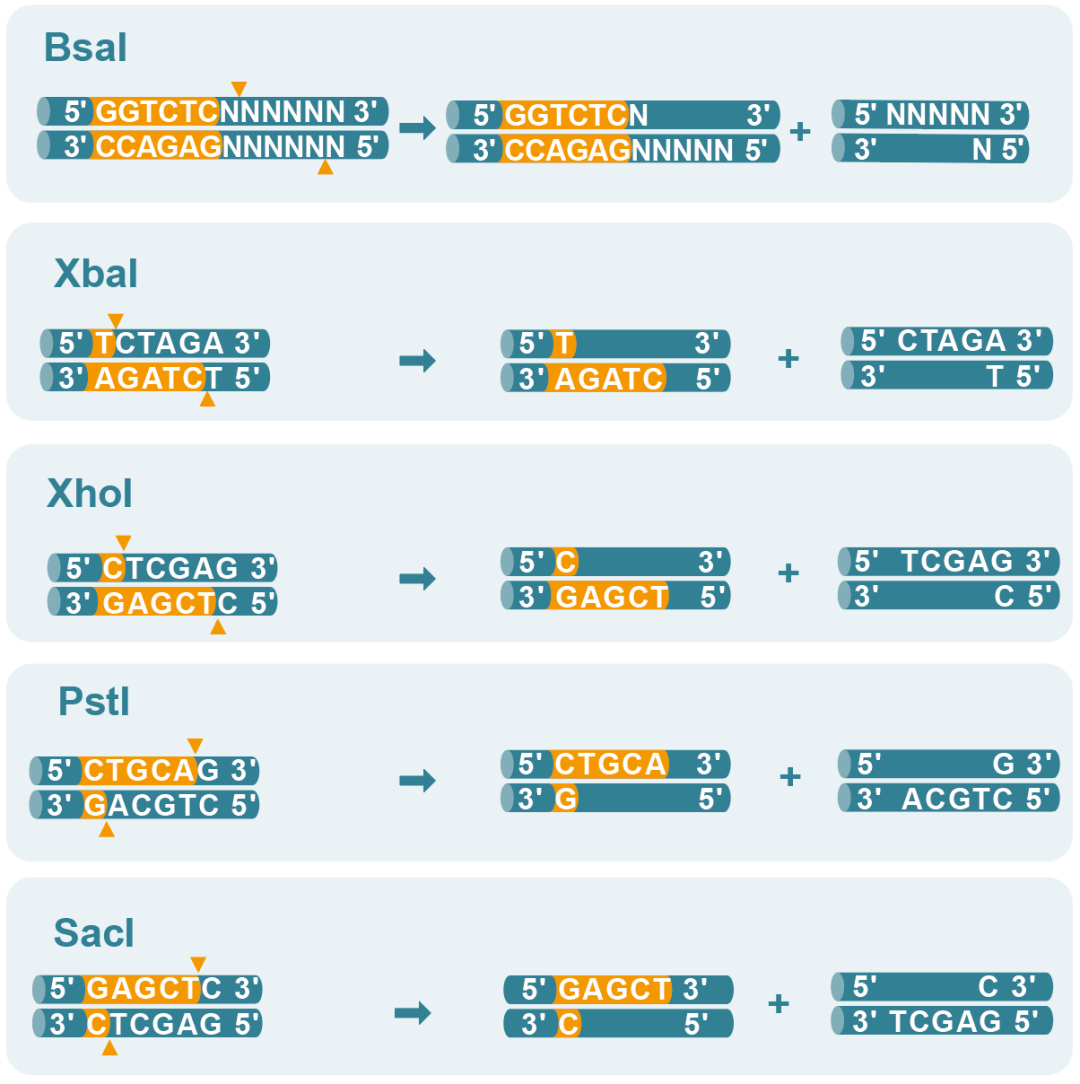
03 無需拘泥于Type IIS限制酶
一般認為,Type IIS限制酶是質粒線性化的首選,因為Type IIS限制酶的酶切位點在識別位點之外,且切割不受序列限制,可以產生不含任何多余序列的模板。
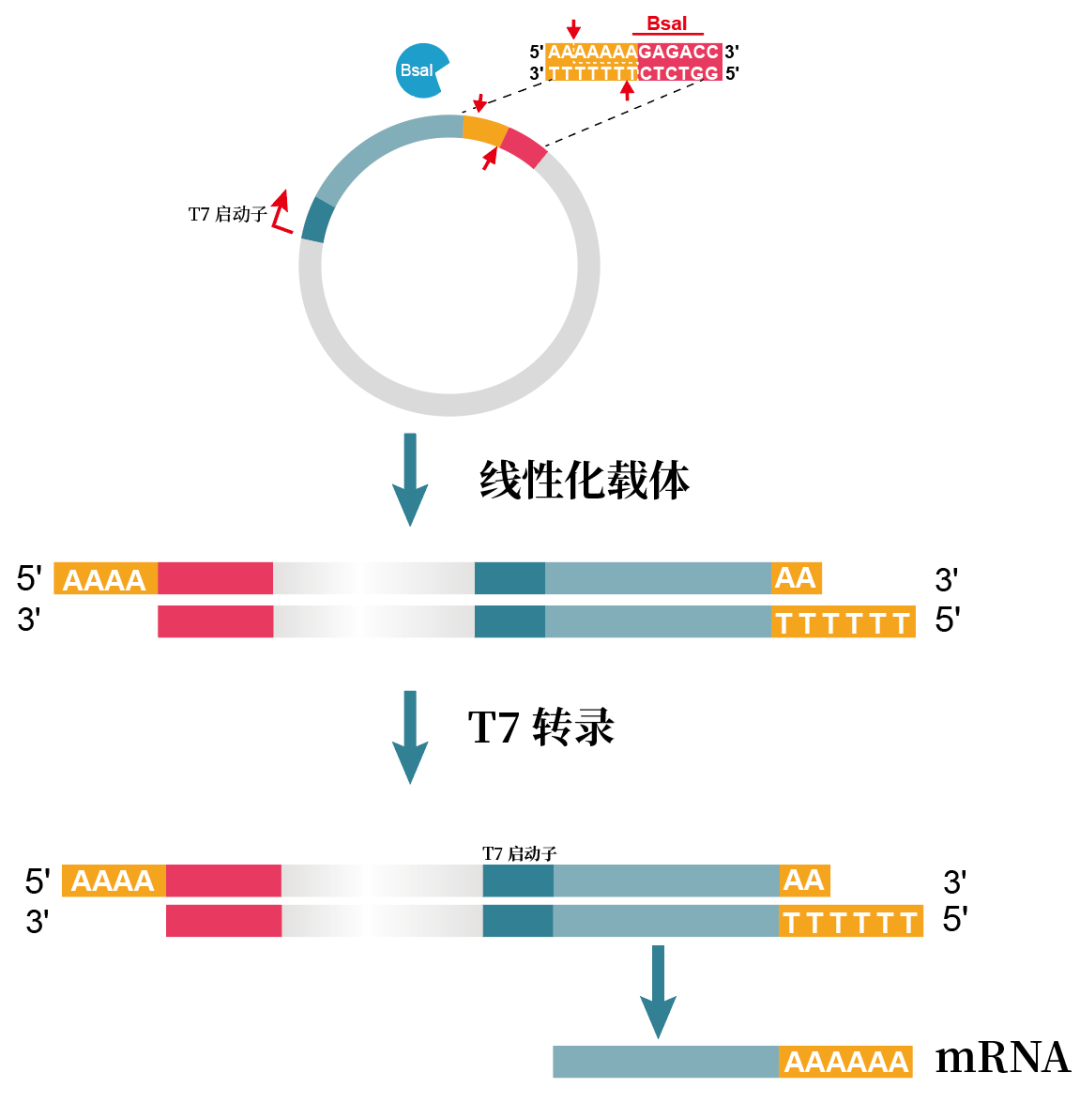
但實際上很多藥企已經證明,Type IIP限制酶,如XbaI、XhoI、NheI、EcoRI等同樣可以用來進行質粒模板線性化,并不會影響mRNA疫苗的效果和安全性。也有部分研究表明,如果poly(A)尾的3'末端帶有額外的酶切位點,還有可能增加mRNA的穩定性。
04 無動物源性
生物制品中的動物源成分存在安全和質量風險,各國藥典都要求優先考慮使用無動物源材料。
愚公生物推出的GMP和ADCF(無動物源性成分)系列限制酶,采用化學成分明確、無動物源性和無人源性成分培養基表達,并經過多步的層析純化獲得。產品的表達、純化和制劑等工藝過程中沒有使用含動物源性和人源性成分的試劑,也未使用氨芐青霉素及其他抗生素。生產設施和包裝材料也沒有使用動物或者動物制品或動物病原體。此外,愚公生物的所有酶制劑最終配方中不含有牛血清白蛋白,取而代之的是更安全可控的重組白蛋白(rHSA)。
05 關注使用后殘留
限制酶作為中間原料,在完成反應后就屬于工藝相關雜質,需要及時去除,避免帶來未知風險。根據法規,對生物制品制造過程中的殘留原料蛋白要進行過程控制檢測。為此,愚公生物推出了多種限制酶的殘留檢測試劑盒(見新品推介l限制酶BsaI殘留檢測試劑盒),用于mRNA原料質量控制。
06 關注酶的穩定性
疫苗與藥物開發與生產對工藝穩定性要求極高。限制酶作為關鍵原料之一,其儲存穩定性也直接影響了工藝的效果。因此應當盡量選擇穩定性更好的酶。
此外,酶的最適反應溫度可能也會影響mRNA質粒模板線性化的效果,但對于這個因素業內尚無明確的共識,所以可以根據自身的需求選擇。
愚公生物擁有國內領先的GMP-like原料酶生產線,提供多種GMP級別和無動物源性限制酶,并接受無動物源性限制酶定制,為國內外mRNA疫苗開發與生產提供優質原料。

愚公生物車間圖
相關產品